
衞生署今日(5日)公布,已於轄下成立「香港藥物及醫(yī)療器械監(jiān)督管理中心(「藥械監(jiān)管中心」)籌備辦公室」,為正式建立「藥械監(jiān)管中心」提出建議和步驟,並為重整和加強藥械及技術(shù)監(jiān)管及審批制度作研究。
2023年施政報告公布,政府會發(fā)揮香港特區(qū)的醫(yī)療優(yōu)勢,長遠(yuǎn)目標(biāo)是建立「第一層審批」的藥物及醫(yī)療器械(藥械)註冊機構(gòu),即可不參考其他藥物監(jiān)管機構(gòu)註冊許可,而直接根據(jù)臨床數(shù)據(jù)在本港審批藥物,同時也開啟審批醫(yī)療器械的註冊申請,藉此加快新藥械臨床應(yīng)用以提升醫(yī)療水平,並帶動建設(shè)藥械研發(fā)和臨床測試的產(chǎn)業(yè)發(fā)展,發(fā)展香港成為國際醫(yī)療創(chuàng)新樞紐。
香港要成為國際藥械權(quán)威監(jiān)管機構(gòu)並落實藥械「第一層審批」涉及6個主要步驟。施政報告公布後至今半年多的時間,特區(qū)政府已全方位主動出擊,並取得成果。
首先,在國家藥品監(jiān)督管理局(國家藥監(jiān)局)的支持及指導(dǎo)下,中國香港已於2023年10月31日成為「國際醫(yī)藥法規(guī)協(xié)調(diào)會議」(ICH)觀察員,使香港可以掌握藥物監(jiān)管最新發(fā)展並推進(jìn)本港藥物監(jiān)管制度,進(jìn)一步與世界衞生組織(世衞)列明規(guī)管機構(gòu)看齊。
第二,特區(qū)政府於2023年11月1日實施全新的「1+」新藥審批機制(「1+」機制)。透過「1+」機制,已取得一個(而非原來的兩個)參考藥物監(jiān)管機構(gòu)註冊許可的合資格新藥持有人,若能提供符合要求的本地臨床數(shù)據(jù),以及經(jīng)本地專家認(rèn)可,便可申請註冊該藥在香港使用。自「1+」機制生效以來,衞生署已收到近70間藥廠超過210個查詢,當(dāng)中包括許多海外及內(nèi)地藥廠,並在機制下批準(zhǔn)兩款治療癌癥的新藥申請,為病人帶來治療新希望。
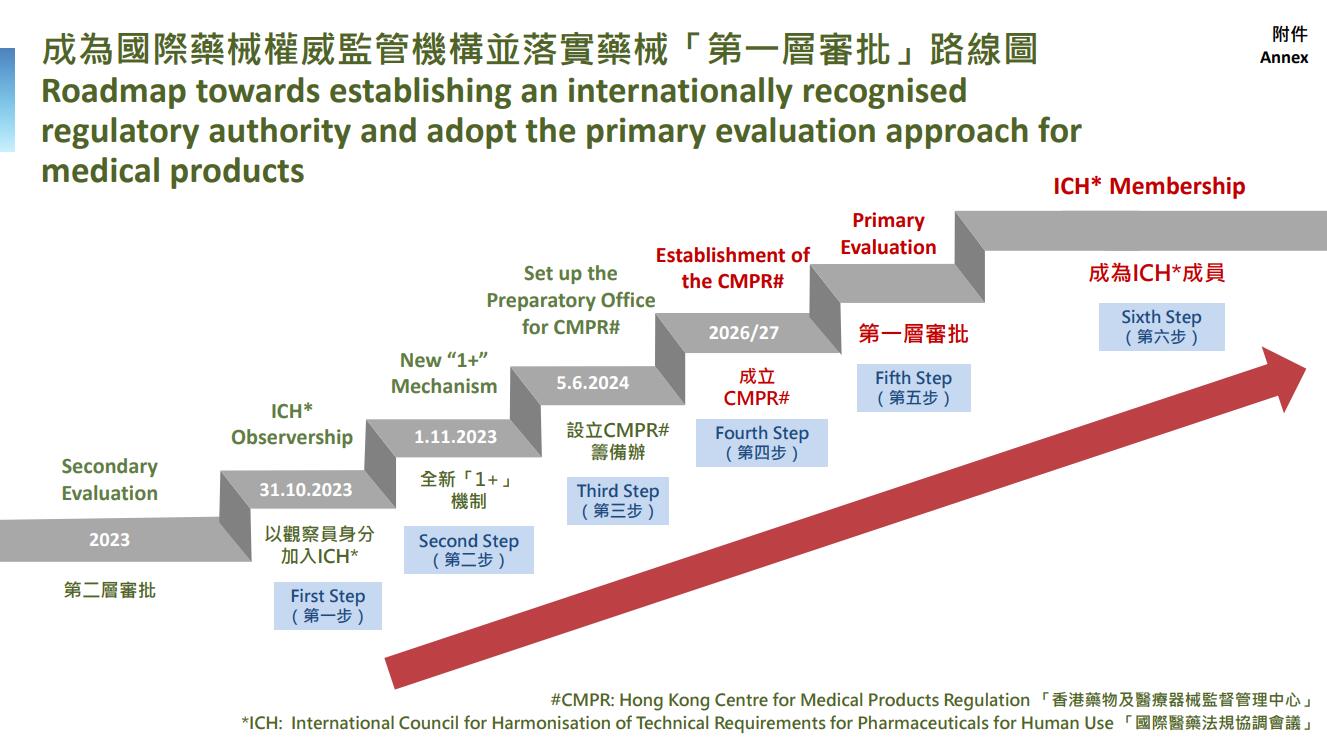
加上今日在衞生署成立「藥械監(jiān)管中心籌備辦公室」,特區(qū)政府已完成6個主要步驟中的首3項。籌備辦公室的具體工作包括整體地研究並規(guī)劃適合本港的藥械監(jiān)管和審批制度;為成立「藥械監(jiān)管中心」提出建議措施和步驟;研究修改現(xiàn)行法例的需要,以推動藥械監(jiān)管發(fā)展;以及為「醫(yī)療創(chuàng)新發(fā)展督導(dǎo)委員會」提供建議,並與不同持份者保持緊密溝通。
特區(qū)政府會繼續(xù)積極跟進(jìn)餘下主要步驟,包括正式成立「藥械監(jiān)管中心」及落實藥械的「第一層審批」。按國際經(jīng)驗,從參與ICH工作到正式成為ICH監(jiān)管機構(gòu)成員一般需時約8至10年。




